Один моль идеального одноатомного газа совершает циклический процесс 1-2-3-4-1, график которого показан на рисунке в координатах \(p-V\). 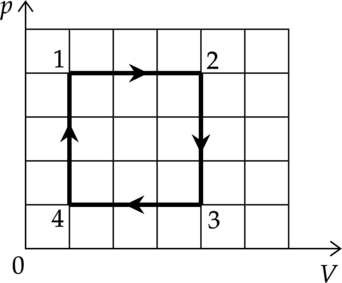
Из предложенного перечня утверждений выберите два правильных и укажите их номера.
1) В процессе 1-2 внутренняя энергия газа увеличивается.
2) В процессе 2-3 газ совершает положительную работу.
3) В процессе 3-4 газу сообщают положительное количество теплоты.
4) В процессе 4-1 температура газа увеличивается в 4 раза.
5) Работа, совершённая газом в процессе 1-2, в 3 раза больше работы, совершённой над газом в процессе 3-4.
1) Внутренняя энергия газа: \[U=\dfrac{i}{2}\nu RT\] где \(\nu\) — количество вещества, \(T\) — температура в Кельвинах, \(R\) — универсальная газовая постоянная, \(i\) — количество степеней свободы газа. В процессе 1-2 температура увеличивается (изобарное расширение), значит внутренняя энергия тоже увеличивается
Утверждение 1 — \(\color{green}{\small\text{Верно }}\)
2) Процесс 2-3 — изохорное охлаждение. При постоянном объеме работа газа равна 0.
Утверждение 2 — \(\color{red}{\small\text{Неверно }}\)
3) Первое начало термодинамики: \[Q=\Delta U+A\] где \(\Delta U\) — изменение внутренней энергии, \(A\) — работа газа, \(Q\) — количество теплоты, полученное газом. В процессе 3-4 \(\Delta U<0\), \(A<0\), следовательно \(Q<0\)
Утверждение 3 — \(\color{red}{\small\text{Неверно }}\)
4) Процесс 4-1 — изохорное нагревание (\(p\sim T\)). Давление увеличивается в 4 раза, значит температура тоже увеличивается в 4 раза. Объем в этом процессе уменьшается, масса не изменяется, следовательно плотность увеличивается.
Утверждение 4 — \(\color{green}{\small\text{Верно }}\)
5) Работа — площадь под графиком в координтах \(p-V\), площадь в процессе 1-2 в 4 раза больше площади 4-3
Утверждение 5 — \(\color{red}{\small\text{Неверно }}\)
Ответ: 14